Съдържание
-
Протеогликани
Протеогликаните са протеини, които са силно гликозилирани. Основната протеогликанова единица се състои от "основен протеин" с една или повече ковалентно прикрепени гликозаминогликанови (GAG) вериги (и). Точката на свързване е серинов (Ser) остатък, към който гликозаминогликанът се присъединява чрез тетразахариден мост (например хондроитин сулфат-GlcA-Gal-Gal-Xyl-PROTEIN). Сер остатъкът обикновено е в последователността -Ser-Gly-X-Gly- (където X може да бъде всеки аминокиселинен остатък, но пролин), въпреки че не всеки протеин с тази последователност има прикрепен гликозаминогликан. Веригите са дълги, линейни въглехидратни полимери, които са отрицателно заредени при физиологични условия поради появата на групи от сулфат и уронова киселина. Протеогликаните се срещат в съединителната тъкан.
-
Глюкопротеин
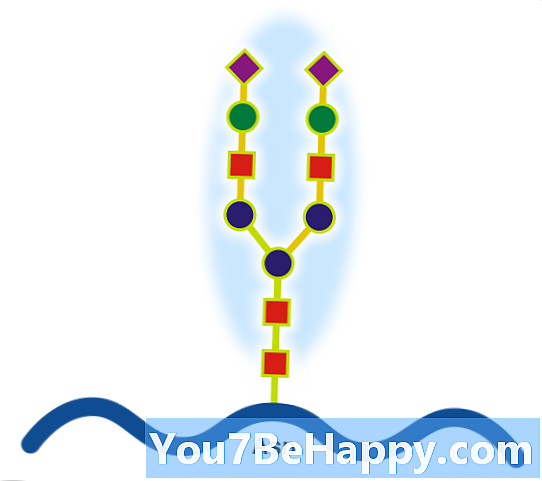
Гликопротеините са протеини, които съдържат олигозахаридни вериги (гликани), ковалентно свързани с аминокиселинни странични вериги. Въглехидратът се свързва с протеина в котранслационна или посттранслационна модификация. Този процес е известен като гликозилиране. Секретираните извънклетъчни протеини често са гликозилирани. В протеините, които имат сегменти, простиращи се извънклетъчно, извънклетъчните сегменти също често са гликозилирани. Гликопротеините също често са важни интегрални мембранни протеини, където те играят роля в взаимодействието между клетките и клетките. Важно е да се разграничи базирана на ендоплазмен ретикулум гликозилация на отделителната система от обратимо цитозолно-ядрено гликозилиране. Гликопротеините на цитозола и ядрото могат да бъдат модифицирани чрез обратимото добавяне на един остатък от GlcNAc, който се счита за реципрочен на фосфорилирането и функциите на тях вероятно са допълнителен регулаторен механизъм, който контролира сигнализацията на базата на фосфорилиране. За разлика от това, класическото секреторно гликозилиране може да бъде от съществено значение. Например, инхибирането на свързано с аспарагин, т.е. N-свързано, гликозилирането може да предотврати правилното сгъване на гликопротеин и пълното инхибиране може да бъде токсично за отделна клетка. За разлика от това, смущаването на преработката на гликан (ензимно отстраняване / добавяне на въглехидратни остатъци към гликана), което се случва както в ендопластичния ретикулум, така и в апарата на Голджи, е необходимо за изолирани клетки (като доказателство чрез оцеляване с инхибитори на гликозиди), но може да доведе до хора болест (вродени нарушения на гликозилирането) и може да бъде смъртоносна при животински модели. Следователно е вероятно фината обработка на гликаните да е важна за ендогенна функционалност, като например трафик на клетки, но това вероятно е второстепенно спрямо нейната роля в взаимодействието между гостоприемник и патоген. Известен пример за този последен ефект е системата от кръвни групи АВО.
Протеогликани (съществително име)
множество от протеогликан
Glycoprotein (съществително име)
Протеин с ковалентно свързани въглехидрати.
Glycoprotein (съществително име)
всеки от клас протеини, които имат въглехидратни групи, свързани към полипептидната верига.
Glycoprotein (съществително име)
конюгиран протеин с въглехидратен компонент